TITRASI ASAM CUKA DALAM CUKA MAKAN 25 % MENGGUNAKAN METODE TITRASI ASAM BASA
Nama :
Jennifer (21)
Jeremy Jason (22)
Jessica Nathania Arunde (23)
Kevin Hendy (24)
Kelas 11 IPA 3
SMA XAVERIUS 1 JAMBI
Mei 2016
(Oleh : Jeremy)
KATA PENGANTAR
Rasa syukur yang sangat mendalam kami panjatkan kehadirat Allah SWT atas
segala rahmat yang diberikan kepada kami sehingga dapat menyelesaikan laporan pratikum ini dengan baik.
Laporan pratikum ini dapat kami selesaikan dengan baik, tak lepas dari banyaknya
pihak-pihak yang turut membantu. Olehnya itu, dengan segala kerendahan
hati, kami ucapkan banyak terima kasih,Terutama kepada guru pembina kami Bu Elizabeth Tjahjadarmawan. Namun, kami pun menyadari bahwa laporan pratikum ini masih jauh dari kesempurnaan. Saran dan kritik dari para
pembacalah yang kami harapkan demi perbaikan laporan ini kedepannya.
Semoga laporan penelitian ini dapat memberikan informasi bagi masyarakat dan bermanfaat
untuk pengembangan wawasan dan peningkatan ilmu bagi
kita semua.
Jambi ,14 Mei 2016
(Oleh : Jeremy)
TUJUAN
Tujuan dari laporan pratikum ini adalah untuk menentukan kadar asam cuka dalam cuka makan melalui metode titrasi asam basa
(Oleh : Jeremy)
MANFAAT
Melalui pratikum ini diperoleh kadar asam cuka dalam cuka makan dengan metode titrasi asam basa.
(Oleh : Jeremy)
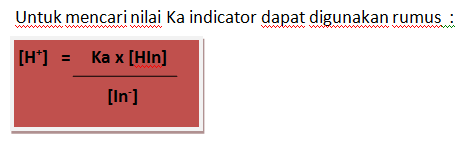
Titik akhir
titrasi yaitu pH pada saat indikator berubah warna dan saat itu juga titrasi
dihentikan. Dalam titrasi ini dipilih indikator PP (fenolflatein) dan BTB (brom
timol biru). Pemilihan indikator tergantung pada titik setara (ekivalen) dan
titik akhir titrasi. Indikator PP pHnya = 8,3 – 10,0. Pada
kondisi asam (pH < 7), indikator PP tidak memberikan perubahan warna,
sedangkan pada kondisi basa (pH > 7) indikator PP memberi warna merah muda. Indikator
BTB pHnya = 6,0 – 7,6. Pada kondisi asam (pH < 7), indikator
BTB memberi warna kuning, sedangkan pada kondisi basa (pH > 7) indikator BTB
memberikan warna biru.
(Oleh : Jeremy)
Agar lebih jelas lagi dapat dilihat di video dibawah
[Oleh : Kevin , Jeremy(video)]
(oleh : Jennifer)
(oleh : Jennifer ,Jessica)
Berdasarkan hasil titrasi dengan menggunakan titran, NaOH 0,1340M, diperoleh kadar asam cuka dari botol cuka 25% v/v sebanyak 5ml dengan menggunakan indikator PP ialah 32,62%. Sedangkan saat dibandingkan dengan kadar yang tertera pada botol cuka makan (25%) ialah 130,48%.
Saat menggunakan indikator BTB, diperoleh kadar cuka makan yaitu 20,368% dan ketika dibandingkan dengan kadar sesungguhnya pada botol cuka makan diperoleh hasil 81,472%. Maka dari itu, perbandingan hasil fakta dengan kadar sesungguhnya memiliki selisih nilai yang cukup jauh.
(oleh : Jennifer)
TEORI DASAR
Titrasi merupakan metode analisis kimia secara kuantitatif yang biasa digunakan dalam laboratorium untuk menentukan konsentrasi dari reaktan. Titrasi asam basa adalah
reaksi penetralan. Titrasi merupakan suatu metode yang bertujuan untuk
menentukan banyaknya suatu larutan dengan konsentrasi yang telah diketahui agar
tepat habis bereaksi dengan sejumlah larutan yang dianalisis atau ingin
diketahui kadarnya atau konsentrasinya. Suatu zat yang akan ditentukan
konsentrasinya disebut sebagai “titran” dan biasanya diletakkan di dalam Erlenmeyer, sedangkan zat yang telah diketahui konsentrasinya disebut sebagai
“titer” atau “titrat” dan biasanya diletakkan di dalam “buret”. Baik
titer maupun titran biasanya berupa larutan.
Titrasi
biasanya dibedakan berdasarkan jenis reaksi yang terlibat di dalam proses
titrasi, sebagai contoh bila melibatkan reaksi asam basa maka disebut sebagai
titrasi asam basa atau aside alkalimetri, titrasi redox untuk titrasi yang
melibatkan reaksi reduksi oksidasi, titrasi kompleksometri untuk titrasi yang
melibatkan pembentukan reaksi kompleks dan lain sebagainya.
Titrasi merupakan suatu metode untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya. Titrasi asam-basa adalah titrasi yang yang melibatkan asam maupun basa sebagai titer (zat yang telah diketahui konsentrasinya) maupun titrant (zat yang akan ditentukan kadarnya) dan berdasarkan reaksi penetralan asam-basa. Kadar larutan asam ditentukan dengan menggunakan larutan basa yang telah diketahui kadarnya, dan sebaliknya, kadar larutan basa dapat diketahui dengan menggunakan larutan asam yang diketahui kadarnya. Titik ekivalen yaitu pH pada saat asam dan basa (titrant dan titer) tepat ekivalen atau secara stoikiometri tepat habis bereaksi.
Titrasi merupakan suatu metode untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya. Titrasi asam-basa adalah titrasi yang yang melibatkan asam maupun basa sebagai titer (zat yang telah diketahui konsentrasinya) maupun titrant (zat yang akan ditentukan kadarnya) dan berdasarkan reaksi penetralan asam-basa. Kadar larutan asam ditentukan dengan menggunakan larutan basa yang telah diketahui kadarnya, dan sebaliknya, kadar larutan basa dapat diketahui dengan menggunakan larutan asam yang diketahui kadarnya. Titik ekivalen yaitu pH pada saat asam dan basa (titrant dan titer) tepat ekivalen atau secara stoikiometri tepat habis bereaksi.
(Oleh : Jeremy)
ALAT DAN BAHAN
Alat :
·
Labu
Elenmeyer (2 buah)
·
Buret
·
Pipet
tetes
·
Tissue
Bahan :
·
Air
·
Cuka
Makan 25%
·
NaOH
·
PP
·
BTB
(Oleh : Kevin)
METODE
1. Foto dan catat cuka botol berkadar 25%.
2. Ambil 5 ml cuka botol, tambahkan air 95 ml
lalu aduk homogen.
3. Ambil masing-masing 5 ml dari larutan
langkah (2) masukan kedalam 2 buah Erlenmeyer.
4. Tambahkan 3 tetes indikator pp titrasi
dengan NaOH 0,1340M menggunakan pipet tetes (1 tetes = 0.05 ml) secara perlahan
dan diaduk homogen. Titrasi hingga warna mencapai TAT (titik akhir titrasi)
yaitu warna pink muda yang permanen dan foto saat mencapai TAT.
5. Catat volume NaOH yang diperlukan (lakukan
2 kali).
6. Lakukan hal yang sama dengan menggunakan
indikator BTB (TAT dicapai saat terjadi perubahan warna dari kuning muda ke
hijau muda yang permanen)
7. Foto dan catat vol NaOH
Agar lebih jelas lagi dapat dilihat di video dibawah
[Oleh : Kevin , Jeremy(video)]
BAGAN CARA KERJA
(Oleh : Kevin)
HASIL PRAKTIKUM
(Oleh : Jessica)
PERHITUNGAN
(oleh : Jennifer)
PEMBAHASAN
Asam asetat atau asam cuka adalah senyawa kimia organik yang dikenal sebagai pemberi rasa asam dan aroma pada makanan. Tujuan dari praktek kali ini pada dasarnya untuk mementukan kadar asam cuka dalam cuka makan dengan menggunakan metode titrasi. Pemilihan indikator yang tepat adalah syarat utama saat titrasi. Jika indikator yang digunakan berubah warna pada saat titik ekuivalen, maka titik akhir titrasi akan sama dengan titik ekuivalen. Indikator yang digunakan dalam prakter ini adalah Phenolphtalein (PP) dan Bromo Timol Biru (BTB). Phenolphtalein akan berubah warna menjadi merah muda (pink) dengan trayek pH = 8,2-10,0 dan Bromo Timol Biru akan berubah warna menjadi hijau muda dengan trayek pH = 6,0-7,6 saat mencapai titik ekuivalen.
Dari praktek yang telah di lakukan, %yield yang didapat saat mengukur kadar cuka menggunakan indikator PP yaitu 130,48%. Hasil didapat nyatanya memiliki selisih yang jauh dengan label yang tertera pada botol cuka makan, yaitu 25% v/v. Demikian juga dengan kadar asam cuka menggunakan indikator BTB, yaitu 81,472%. Perbedaan % hasil antara penggunaan indikator PP dan BTB dikarenakan perbedaan trayek pH yang dimiliki indikator tersebut.
Terdapat perbedaan antara %yield dengan kadar asam cuka dalam cuka makan (25%). Hal ini terjadi disebabkan oleh beberapa faktor, seperti suhu ruangan tempat penelitian, cara pengadukan saat titrasi, cara penetesan titran sehingga menimbulkan besar volume yang beragam setiap tetesnya (dibulatkan menjadi 0,05ml), tingkat kesterilan peneliti dan alat-alat praktek hingga pengaruh gas-gas lain yang bertebaran di udara seperti CO2.
(oleh : Jennifer ,Jessica)
KESIMPULAN
Berdasarkan hasil titrasi dengan menggunakan titran, NaOH 0,1340M, diperoleh kadar asam cuka dari botol cuka 25% v/v sebanyak 5ml dengan menggunakan indikator PP ialah 32,62%. Sedangkan saat dibandingkan dengan kadar yang tertera pada botol cuka makan (25%) ialah 130,48%.
Saat menggunakan indikator BTB, diperoleh kadar cuka makan yaitu 20,368% dan ketika dibandingkan dengan kadar sesungguhnya pada botol cuka makan diperoleh hasil 81,472%. Maka dari itu, perbandingan hasil fakta dengan kadar sesungguhnya memiliki selisih nilai yang cukup jauh.
(oleh : Jennifer)
SARAN
1. Sebelum melakukan penelitian, sebaiknya perhatikan kembali kesetrilan peneliti dan alat-alat yang digunakan guna memperoleh hasil yang lebih akurat.
2. Usahakan cara pengadukan saat titrasi benar-benar homogen demi hasil akhir yang lebih akurat ( perubahan warna) .
3. Lakukan pengukuran volume larutan dengan lebih teliti.
4. Usahakan tempat penelitian jauh dari area-area yang menyebabkan timbulnya gas-gas lain yang dapat mempengaruhi hasil penelitian.
5. Ambil foto setiap perlakuan dalam penelitian sebagai dokumentasi.
(oleh : Jessica)
(oleh : Jessica)
PENUTUP
Demikianlah laporan ini telah kami selesaikan dengan sebagaimana mestinya. Kami sangat berterima kasih kepada semua pihak yang telah membantu dalam pembuatan laporan ini. Terkhusus kami mengucapkan terima kasih kepda Ibu Elizabeth Tjahjadarmawan, S.Si, M.Pd selaku guru pembimbing kimia yang telah memepercayakan kami dalam melakukan penelitian dan memampukan kami menyelesaikan laporan ini.
Namun, laporan ini pun tidak terlepas dari segala keterbatasan dan kesalahan.Untuk itu kami sangat menerima saran dan kritikan dari para pembaca. Semoga laporan ini bermanfaat bagi para pembaca maupun peneliti selanjutnya.
Jambi, 14 Mei 2016
(oleh : Jessica)
DAFTAR PUSTAKA
Tjahjadarmawan, Elizabeth. 2016. Bernas Kimia Jilid 2. Jogjakarta : Citra Media
https://rizki2812.wordpress.com/2012/04/13/penentuan-kadar-asam-asetat-dalam-asam-cuka/
Penulis laporan : Jennifer, Jessica, Jeremy, Kevin
Foto dan Video : Jeremy